

多发性骨髓瘤(Multiple Myeloma,MM)是第二常见的血液系统恶性肿瘤,传统疗法面临复发耐药难题。近日,江西省生化学会常务理事、南昌大学第二附属医院检验科王小中教授与黄波副教授领衔的研究团队,在国际权威期刊《Cell Death and Disease》(IF=9.6)上发表了题为《METTL5 regulates SEPHS2-mediated selenoprotein synthesis to promote multiple myeloma survival and progression》的重要研究论文。该研究首次揭示了RNA甲基转移酶METTL5通过调控硒代谢关键酶SEPHS2的翻译效率,维持MM细胞氧化还原稳态并促进其生存的新机制,并筛选出天然化合物丹酚酸C(Salvianolic Acid C,SAC)作为靶向METTL5的高效抑制剂,为MM治疗提供了全新策略。

一、研究背景
多发性骨髓瘤(Multiple Myeloma,MM)作为仅次于淋巴瘤的第二大血液系统恶性肿瘤,其治疗至今面临两大临床困局:
1. 耐药高发:尽管蛋白酶体抑制剂、免疫调节药物等疗法显著延长患者生存期,但超过70%患者最终因耐药复发死亡;
2. 靶点稀缺:驱动MM生存的关键代谢机制不明,缺乏精准干预策略。
近年研究发现,肿瘤细胞通过代谢重编程构建防御屏障是其核心耐药机制之一。其中,硒代谢通路扮演关键角色:
1. “硒盾”假说:MM细胞高表达硒蛋白(如GPX4),清除活性氧(ROS)并抑制DNA损伤,抵抗凋亡压力;
2. 治疗矛盾:外源硒剂虽可杀伤肿瘤,但代谢限速酶SEPHS2的调控机制未知,导致靶向干预无门。
与此同时,RNA表观遗传修饰研究揭示:核糖体RNA甲基转移酶METTL5在实体瘤中异常活化,通过18S rRNA上m⁶A₁₈₃₂修饰调控全局翻译效率。但METTL5是否驱动MM的代谢逃逸?能否成为破解“硒盾”的新靶点?——这些问题悬而未决。
二、研究亮点
1. 临床关联性:首次发现METTL5在初诊MM患者骨髓中显著高表达,且与不良预后密切相关。
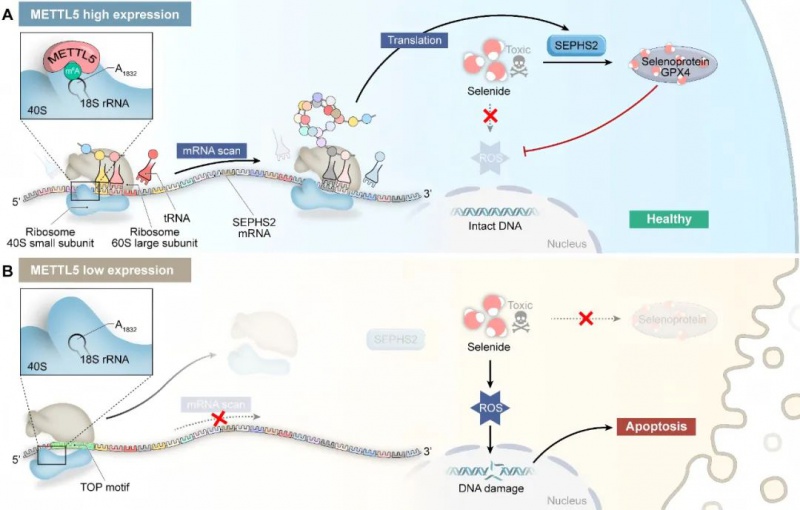
2. 促癌新机制:METTL5通过催化18S rRNA上m⁶A₁₈₃₂位点修饰,增强40S核糖体对SEPHS2 mRNA 5’ TOP基序的识别,特异性提升SEPHS2蛋白翻译效率(非mRNA水平)。
3. 代谢重编程:SEPHS2是硒代谢限速酶。METTL5-SEPHS2轴促进谷胱甘肽过氧化物酶4 (GPX4)等硒蛋白合成,维持MM细胞抗氧化能力,防止活性氧(ROS)累积和DNA损伤诱导的凋亡。
4. 靶向治疗突破:通过高通量虚拟筛选,首次发现中药丹参活性成分丹酚酸C(SAC)是METTL5的高效抑制剂。SAC能有效抑制METTL5活性及其介导的SEPHS2翻译和硒代谢通路,在体外和小鼠模型中显著抑制MM进展并延长生存期,且安全性良好。
三、关键研究成果
1. METTL5是MM不良预后因子:在GSE6477数据集及本院队列中,METTL5在MM患者(尤其初诊组)骨髓细胞中表达显著高于健康对照及缓解期患者,且高表达预示更差的总生存期(OS)。
2. METTL5驱动MM进展:体外实验证实,过表达METTL5促进MM细胞增殖、抑制凋亡、加速细胞周期;在MM原位移植小鼠模型中,过表达METTL5加速肿瘤生长、增加骨髓浸润、缩短生存期。反之,敲低METTL5则抑制上述表型。
3. 靶向SEPHS2翻译调控硒代谢:Ribo-seq等分析发现,METTL5缺失主要影响全局蛋白翻译效率,其中SEPHS2是翻译效率下调最显著的基因之一。机制上,METTL5通过增强40S核糖体对SEPHS2 mRNA 5’ UTR区特异性TOP基序的识别,促进其翻译(不影响mRNA水平)。SEPHS2下调导致其催化产物硒代半胱氨酸(Sec)及下游硒蛋白GPX4、TXNRD1合成减少。
4. 硒代谢障碍诱导凋亡:SEPHS2/硒蛋白减少导致ROS累积,引发DNA损伤(γ-H2AX↑)和凋亡相关蛋白(caspase-3,PARP1裂解↑)活化,最终诱导MM细胞凋亡。回复SEPHS2表达可部分挽救METTL5缺失导致的表型。
5. 丹酚酸C(SAC)是高效METTL5抑制剂:基于结构的虚拟筛选从12862个化合物中锁定SAC。分子对接显示SAC与METTL5活性口袋结合紧密(预测形成9个氢键等)。实验证实:
① SAC有效抑制MM细胞中METTL5蛋白及18S rRNA m⁶A₁₈₃₂修饰水平。
② SAC降低全局蛋白翻译效率及SEPHS2/GPX4表达,增加ROS和凋亡。
③ 过表达METTL5可部分逆转SAC的效应,证实其靶向特异性。
④ 在MM小鼠模型中,SAC治疗显著降低肿瘤负荷、减少骨髓浸润、延长生存期,且未观察到明显器官毒性。
四、研究意义与临床价值
本研究不仅阐明了METTL5-SEPHS2-硒蛋白轴在MM发生发展中的关键作用和全新分子机制,更重要的是:
1. 首次将核糖体RNA修饰 (METTL5-m⁶A₁₈₃₂) 通过40S核糖体介导扫描机制与硒代谢重编程(SEPHS2-硒蛋白)联系起来,为理解MM的代谢依赖提供了新视角。
2. 首次发现天然化合物丹酚酸C(SAC)是METTL5的有效抑制剂,并证实其在体外和体内模型中具有良好的抗MM活性及安全性,为开发靶向METTL5的MM治疗药物提供了极具前景的先导化合物。
3. METTL5的高表达与MM不良预后相关,提示其可能作为MM预后生物标志物,并为精准治疗(如对高表达患者使用SAC)提供依据。
作者信息
博士生姜钧耀、钟芳敏和赣州市人民医院肖作淼主任技师为该论文并列第一作者。南昌大学第二附属医院王小中教授和黄波副教授为该论文共同通讯作者。
原文链接:https://doi.org/10.1038/s41419-025-07904-6
分享到: