

肝脏作为人体的“生化工厂”,承载着解毒、代谢、合成等生命核心功能。当肝脏遭遇重度损伤(如晚期肝硬化、肝癌),纤维化将彻底剥夺肝细胞的再生能力,此时肝移植是唯一生路——但全球供体短缺与移植排斥反应犹如两座大山,使晚期肝病患者长期深陷“无药可医”的困境。如何激活重度损伤下的肝脏再生潜能?这一科学难题直接关乎千万患者生命。
2025年2月20日,赣南医科大学第一附属医院陆辉强课题组在国际发育生物学研究领域顶刊《Development》发表题为"Activation of prep expression by Tet2 promotes the proliferation of bipotential progenitor cells during liver regeneration"的研究成果,精准锁定调控肝脏再生的核心因子——丝氨酸肽酶脯氨酰内肽酶(Prep),并揭示其通过表观遗传机制激活双潜能祖细胞(BP-PCs)增殖的分子通路,为晚期肝病再生修复难题提供可能策略!

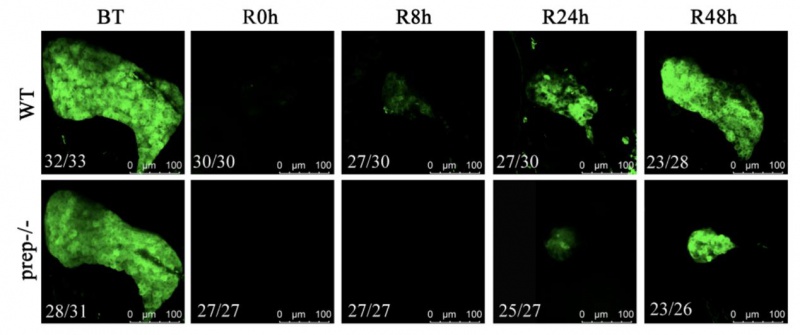
研究团队利用斑马鱼重度肝损模型发现:在肝脏濒临衰竭的极端条件下,Prep可令肝脏再生速度提升3倍以上,并驱动BP-PCs呈“爆发式”增殖。更令人振奋的是,团队首次揭秘DNA去甲基化酶Tet2的核心作用——它直接结合prep基因启动子,清除DNA甲基化“封印”,使prep表达水平飙升;而Prep则通过激活PI3K-AKT-mTOR“再生信号高速公路”,最终完成肝脏重建。这项研究不仅首次绘制出Tet2-Prep表观遗传调控轴的作用图谱,更开创性地证明:靶向DNA去甲基化可精准唤醒肝脏内源性再生潜能。相较于传统肝移植,该策略无需外源供体、规避免疫排斥,有望使肝硬化、肝癌患者通过自身细胞再生获得治愈。
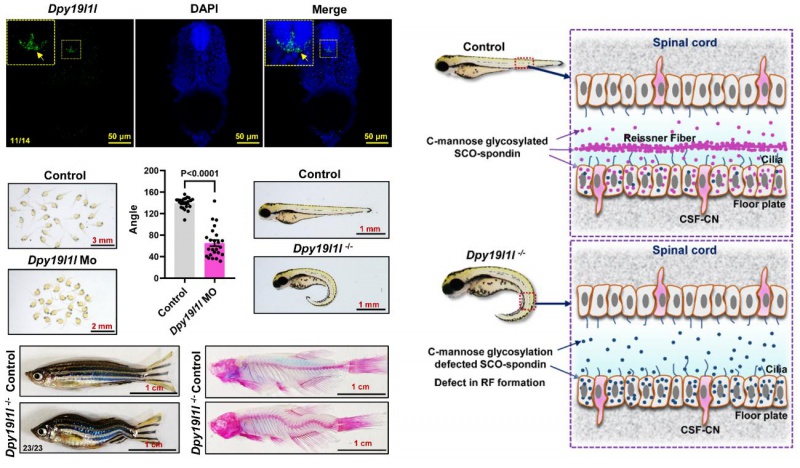
5月9日,陆辉强教授课题组再次在国际顶级期刊《Science Advances》(《科学》子刊)发表题为“C-mannosyltransferase DPY19L1L-mediated Reissner Fiber formation is critical for zebrafish (Danio rerio) body axis straightening”的特发性脊柱侧凸(IS)致病机制重要研究成果,该研究揭示糖基转移酶DPY19L1L通过关键修饰调控SCO-spondin蛋白,驱动赖斯纳氏纤维形成并维持脊柱正常发育的核心机制,为破解困扰医学界百年的脊柱侧凸病因谜团带来新的曙光。

特发性脊柱侧凸作为全球3%青少年的"隐形骨骼杀手",患者常年承受支具矫正的生理折磨与高达数十万元的开放式手术风险,数百万家庭因沉重的医疗负担陷入困境,病因不明的根本困境导致药物研发长期停滞,国际医学界百年探索未果。陆辉强教授团队锁定DPY19L1L-SCO通路这一全新靶点,首次构建"糖基化修饰-纤维形成-脊柱稳态"理论框架,研究成果有望颠覆传统诊疗模式,为开发靶向治疗药物开辟革命性路径,被审稿专家誉为"脊柱发育研究领域的突破性进展"。
两项研究由论文唯一通讯作者陆辉强教授领衔,在国家重点研发计划、国家自然科学基金面上项目、江西省自然科学基金重点项目等大力资助下,带领田贵游等青年学者和贾坤、黄丽蓉、徐朝鹏等硕士研究生历时多年攻坚完成。复旦大学罗凌飞教授、中国海洋大学赵呈天教授为该研究提供了重要指导、关键品系资源和实验材料。
论文链接:
https://doi.org/10.1242/dev.204339;https://www.science.org/doi/10.1126/sciadv.adv2032
分享到: