

Hedgehog (Hh)信号通路是调控动物胚胎发育和成体组织稳态的关键信号通路之一,其活性失调将导致出生缺陷甚至肿瘤发生。Hh通路最早于1980年通过果蝇突变体筛选而发现,并在1995年获得诺贝尔奖。Hh是分泌蛋白,作为该通路的始发因子,可与膜表面受体结合,激活信号跨膜转导,最终将信号传递给转录因子Ci/GLI,调控靶基因表达。

目前大量的研究表明,Hh信号通路主要通过调节Ci/GLI的核定位和蛋白稳定性,调控下游靶基因表达。当Hh信号缺失时,Ci/GLI被锚定在细胞质的微管上,并被一系列蛋白激酶磷酸化修饰,进而被泛素连接酶Slimb/b-TRCP-CUL1降解。当Hh信号激活时,Ci/GLI蛋白入核,与转录辅助因子CBP结合,激活靶基因表达。但是,进入细胞核Ci/GLI的活性如何调节,至今尚不清楚。2024年11月12日,PNAS在线发表了江西师大周紫章教授团队完成的研究论文“Tai/NCOA2 suppresses the Hedgehog pathway by directly targeting the transcription factor Ci/GLI”。该论文发现,轻微激活Hh通路(过表达膜受体Smo),并不能显著上调靶基因表达,暗示Ci/GLI活性受到限制。经过遗传筛选,作者鉴定到转录因子Taiman (Tai)/NCOA2显著抑制Ci/GLI靶基因表达。Tai作为昆虫蜕皮激素和保幼激素通路的重要转录因子,但其对Hh通路的调控并不通过经典的激素通路。通过体细胞克隆技术,作者发现Tai/NCOA2仅抑制Hh信号的转导,并不影响Hh蛋白的分泌。遗传学互补实验结果显示,Tai/NCOA2直接抑制Ci/GLI转录活性。大量生化实验结果表明,Tai/NCOA2与Ci/GLI存在直接相互结合,并且结合在Ci/GLI的DNA结合结构域(DBD)。Tai/NCOA2结合在Ci/GLI-DBD,降低了Ci/GLI与DNA的亲和力,抑制靶基因的转录。作者还借助转录组测序,发现Tai/NCOA2对Ci/GLI的抑制效应具有广谱性,对大部分Ci/GLI上调的基因均呈现抑制作用。
 图1. 过表达/敲降Tai均导致翅脉紊乱
图1. 过表达/敲降Tai均导致翅脉紊乱
当Hh信号激活时,Tai/NCOA2与Ci/GLI的亲和力显著降低,进而Ci/GLI与DNA结合,激活基因表达。本研究揭示了Hh不仅调控Ci/GLI蛋白定位和稳定性,还影响Ci/GLI与DNA的亲和力,加强了对Hh通路稳态维持的认识。周紫章团队博士研究生于璇为本论文的第一作者,周紫章教授为独立通讯作者,江西师范大学为论文的通讯单位。该工作受国家自然科学基金优青项目、面上项目、科技部重点研发计划和江西省双千领军人才项目的资助。
论文链接:https://www.pnas.org/doi/10.1073/pnas.2409380121
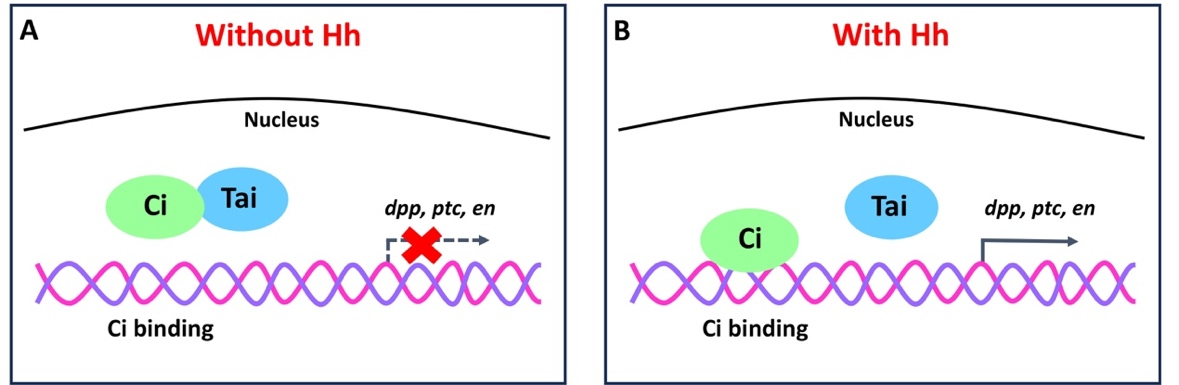 图2. Tai调控Hh通路的模式图
图2. Tai调控Hh通路的模式图
分享到: